 |
|
넷플릭스 다큐멘터리 ‘부자연의 선택’. 출처: 넷플릭스
|
김준혁의 의학과 서사(26)
‘부자연의 선택’ 두 번째, 동물 유전자 조작과 환경 문제
 |
|
넷플릭스 다큐멘터리 ‘부자연의 선택’. 출처: 넷플릭스
|
“지금은 20XX년입니다. 제가 사는 이 섬에는 동물이라곤 두 종류밖에 없습니다. 저희 인간, 그리고 대형 쥐인데요. 물론 2010년대까진 섬에 여러 동물이 살고 있었어요. 갖가지 새가 노래하고 토끼와 다람쥐가 뛰어놀았지요. 당시에도 이미 쥐가 다른 동물을 몰아낼 거라는 우려가 크긴 했지만 쥐덫, 쥐약 같은 예전 방식으로 쥐 개체 수를 충분히 줄일 수 있으리라 믿었던 것 같아요. 결과는 지금 보시는 것처럼 처참한 실패지요. 쥐는 인간이 아무리 덫을 놓고 약을 깔아도 번식했으며, 새를 비롯한 작은 동물들을 공격해 하나씩 멸종시키기 시작했습니다. 심지어 수가 많지 않았던 말과 소 같은 큰 동물도 버텨내질 못했어요. 정확히는 새끼를 안전하게 보호하지 못했다고 말해야겠죠. 이제 어딜 봐도 찍찍거리는 소리만 가득해요. 인간들마저 쥐를 어떻게 피할지 걱정하고 있습니다. 미리 손을 썼더라면 피할 수 있었을 텐데 안타까울 뿐이에요.”
위에 적어 놓은 상상은 완전히 허구는 아닙니다. 뉴질랜드는 지금 쥐로 큰 고민에 빠져 있어요.[1] 외래종인 쥐, 주머니쥐, 담비가 새를 멸종 위기로 몰아가고 있습니다. 약물 살포 등으로 문제를 해결하지 못한 뉴질랜드 정부는 최신 과학을 도입하기로 했습니다. “2050년까지 포식동물 없애기” (Predator-Free 2050) 정책을 2017년 승인한 정부는 크리스퍼-캐스9(이하 크리스퍼) 유전자 가위를 활용한 유전자 조작을 통해 쥐 번식을 어렵게 만드는 유전자를 퍼뜨리기로 합니다. 여기에 뛰어든 것이 엠아이티(MIT) 유전 공학자 케빈 에스벨트(Kevin Esvelt)인데요, 그는 유전자 드라이브(gene drive)라는 기술을 활용해 쥐 유전자를 급속도로 변경하는 계획을 세운 뒤 기술 적용을 위해 지역사회 설득에 나섭니다.
 |
|
뉴질랜드 정부는 2050년까지 비(非)재래종 포식자를 절멸하기 위한 국가 공공 사업을 시작했다. 덫을 설치하고 독극물을 살포하는 등의 방법을 동원함과 동시에, 정부는 유전자 조작 기술을 활용하여 효과적으로 사업을 진행하고자 한다. 이 사업에 유전자 조작 기술을 사용해도 될까? 신기술은 단지 포식자만 절멸하는 효과만 나타낼까? 출처: 프리데이터 프리 2050 누리집
|
과연 유전자 조작을 통해 환경에 영향을 미쳐도 되는 걸까요? 그것은 아무런 문제 없이 활용될 수 있을까요? 위에서 소개한 미래를 막기 위해 우리가 택할 방법이 유전자 조작밖에 없다면 우리는 이제 행동에 나설 때가 된 걸까요? 지난 칼럼에 소개한 다큐멘터리 ‘부자연의 선택’ (Unnatural Selection) 내용에서 상당 부분을 차지하는 것이 에스벨트와 같은 연구를 수행하고 있는 학자들의 노력, 이 기술을 적용하려는 지역사회의 반응, 여기에 우려를 표하는 환경 보호 운동가의 목소리입니다. 이번에는 이 세 가지 관점을 각각 살펴보려 해요. 이것은 앞으로 유전자 조작을 둘러싸고 벌어질 논쟁 구도를 미리 보여주고 있는 예시이기 때문입니다. 과학자, 지역사회, 반대론자는 각각 어떤 생각으로 문제에 임하고 있으며, 우리는 여기에서 어떤 통찰을 얻을 수 있을까요?
종을 확실히 절멸하는 유전자 드라이브 기술
먼저 동물, 곤충 유전자 조작과 유전자 드라이브 기술에 관해 간단히 살펴보겠습니다. 인류에게 가장 큰 위협이 되는 생물은 무엇일까요? 앞서 말씀드린 쥐나 엄청난 생존력을 자랑하는 바퀴벌레일까요? 아닙니다. 우리는 그저 여름밤의 불청객이라 여길 뿐인 모기입니다. 여전히 매년 3억~5억명의 환자가 발생하고, 200만명 이상이 말라리아로 사망합니다.[2] 플라스모디움 속 기생충이 척추동물 적혈구에 기생하는 질병인 말라리아를 옮기는 것이 모기입니다. 모기가 사람에게 포자를 옮기고, 포자가 사람 몸 속에서 급속도로 증식하는 것이죠. 최근 인천 을왕산에서 발견되어 걱정을 불러온 ‘뎅기열 모기’로 인해[3] 필리핀에선 10만명이 뎅기열에 감염, 500명에 가까운 사망자가 발생했습니다.[4] 2016년 브라질 올림픽은 신생아 소두증을 일으킬 수 있는 지카 바이러스 때문에 어려움을 겪었죠. 기억하시겠지만, 지카 바이러스를 옮기는 것 또한 모기입니다.
모기만 효과적으로 차단해도 수많은 사람을 질병으로부터 보호할 수 있을 겁니다. 그렇다면 모기를 어떻게 막을까요? 살충제나 모기장과 같은 전통적인 방법에 한계가 있음을 우리는 모두 경험으로 알고 있습니다. 이런 방법으로 모기를 막는 것에는 한계가 있지요. 그렇다면, 유전자 조작 기술을 활용하는 것은 어떨까요. 연구진들은 생존을 위해 특정 화학 물질을 필요로 하는 수컷 모기를 만들어 풀어놓는 방법을 생각해 보았습니다.[5] 모든 모기가 아무 때나 피를 빠는 것은 아닙니다. 산란기에 동물성 단백질을 필요로 하는 암컷 모기가 흡혈을 하는 것이죠. 그렇다면, 수컷 모기는 흡혈을 하지 않기 때문에 풀어놓아도 기생충이나 바이러스를 전염시킬 위험이 없습니다. 게다가, 야생 모기와 결합해 번식하면 다음 세대 또한 특정 화학 물질을 필요로 하지만 이것은 자연 상태에서 구할 수 없는 물질이라 곧 죽어버립니다. 아예 불임 수컷 모기를 만들기도 했지요. 이런 수컷 모기와 야생 암컷 모기가 낳은 알은 부화하지 못합니다. 결국, 모기의 수가 줄어들게 된다는 것이죠.
문제는, 지속성이 떨어지는 방법이라는 데 있었습니다. 후대를 만들어내지 못하는 모기를 퍼뜨리는 것이므로, 시간이 지나면 유전자 조작 모기는 다 죽어버릴 것이고 남은 모기들이 다시 원래 상태로 돌아가는 것은 어렵지 않다는 것이죠. 게다가, 수컷 모기를 방생하므로 모계 쪽의 정상 유전자는 그대로 살아남고, 결국 조작된 유전자는 세대를 지나면서 점점 사라지게 되는 것이죠. 그렇다면 유전자 조작 모기를 계속 만들어서 살포해야 합니다. 결국, 진일보한 살충제일 뿐 별다른 차이는 없다고 말할 수도 있겠네요.
여기에 크리스퍼가 등장합니다. 물론, 앞서 말씀드린 불임 모기를 적은 비용으로 대량 생산하는 데에도 크리스퍼가 큰 역할을 할 수 있습니다. 그러나 크리스퍼는 더 나은 해결책을 제시합니다. 아예, 불임 유전자를 만드는 유전자 가위를 모기 유전자에 심어버리면 어떨까요? 이를 유전자 드라이브라고 부릅니다. 원하는 유전자 조작 과정을 유전자 자체가 실어 나르는 것이죠. 엄밀히 말하면, 유전자 드라이브 기술은 두 가지로 구성됩니다. 원하는 방식으로 조작된 유전자가 하나요, 해당 부위를 잘라내는 유전자 가위가 둘입니다. 이 둘 모두를 유전자 조작 개체는 후손에게 전달합니다. 후손에서 유전자 가위 부분이 발현하면, 비조작 부모로부터 받은 유전자를 잘라냅니다. 세포는 잘라진 유전자를 복구하는 단백질을 원래 가지고 있고, 유전자가 잘려 나간 부분을 복구하려 시도합니다. 그러나, 비조작 부모로부터 받은 유전자는 이미 사라졌기에 단백질은 조작된 유전자를 틀로 해서 복구를 진행합니다. 결국, 후손에게 남는 유전자 두 쌍은 모두 조작된 형태가 되는 것이죠.
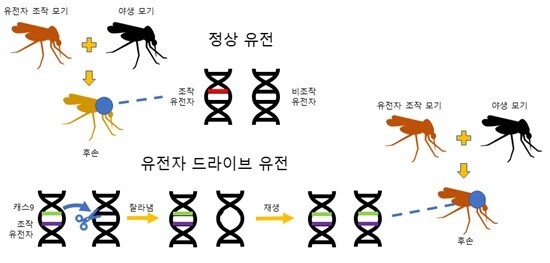 |
|
유전자 조작 수컷을 그냥 풀어놓는 경우, 정상적인 유전자 전달 과정에 따라 후손은 조작된 유전자 하나, 조작되지 않은 유전자 하나를 가진다. 이것은 항상 작동하지 않을 뿐더러, 후손에게 계속 유전되지도 않는다. 그러나, 유전자 드라이브 유전의 경우 유전자 가위를 유전자 자체에 내장한다. 조작 유전자와 가위를 한꺼번에 전달받은 후손은 조작되지 않은 유전자를 잘라내어 조작된 유전자 형태로 스스로 변형하게 되고, 후대에 100% 조작 유전자를 전달하게 된다. 시각화는 필자.
|
다시 수컷 모기의 예로 돌아가 볼까요. 유전자 조작을 할 수 있는 유전자를 지닌 수컷 모기를 방생합니다. 이 모기는 그 자신 불임 유전자를 가지고 있으며, 그렇게 만들어진 자손에서 다시 불임 유전자 조작을 일으키는 유전자 또한 물려줍니다. 2018년에 네이처 바이오테크놀로지에 개재된 논문[6]은 모기 성별에 영향을 미치는 유전자를 조작하도록 만들어, 수컷 모기는 그대로 태어나고 암컷 모기만 불임으로 태어나게 만들었습니다. 10세대 정도가 지나자, 실험 대상으로 장 안에서 키우던 모기는 전부 불임이 되어 결국 사멸해 버렸어요.
이 방법은 모기와 쥐 등에 모두 적용할 수 있을 거예요. 살충제도, 장막과 덫도 해결하지 못한 유해생물 문제에 대해 유전자 조작이 강력한 해결책을 들고 나온 것입니다. 유해생물을 박멸하려는 노력은 계속되어 왔고, 그저 새로운 기술이 등장한 것일 뿐 달라진 것은 없는지도 모르겠어요. 하지만, 그렇게 간단한 문제는 아니죠.
유전자 드라이브 기술을 바라보는 세 가지 견해
다큐멘터리 ‘부자연의 선택’은 미국에서 연구기금을 받아 뉴질랜드 쥐 문제를 해결하려고 뛰어든 에스벨트가 지역 주민을 만나 설득하는 장면을 상당한 시간을 할애하여 담아냈습니다. 유전자 드라이브를 적용한 쥐를 풀어놓으려면 지역 주민의 동의가 필요하고, 에스벨트는 유전자 드라이브가 강력한 힘을 지니고 있으며 기술은 지금까지 인간이 저지른 잘못을 교정하는 방법이라는 의견을 계속 표명합니다. 그가 보기에, 현재 환경은 지속 가능하지 않습니다. 이미 인간이 이곳저곳 개입한 탓에 자연은 스스로 복구할 수 없을 만큼 망가져 버렸지요. 그렇다면, 이 상황을 다시 수선해야 하는 것도 인간이어야 한다고 에스벨트는 믿습니다. 생태계 균형이 파괴되었다면, 다시 회복할 수 있도록 인간이 손을 대어야 한다는 거지요. 뉴질랜드의 쥐 문제는 에스벨트가 생각하는 지속 불가능한 환경 문제의 전형입니다. 가만히 놓아둔다고 하여 쥐가 스스로 줄어들 리가 없습니다. 결국 쥐는 점점 불어나 다른 동물을 모두 멸절시킬 겁니다. 그 전에, 인간이 개입하여 쥐를 줄여야 하고, 전통적인 방법은 모두 실패했으나 유전자 조작 기술은 성공할 거라고 그는 생각합니다.
 |
|
엠아이티 미디어랩 교수이자 유전 공학자인 케빈 에스벨트는 ‘네이처’에 실린 인터뷰에서 우리가 생태계를 회복하고 위험에 처한 야생의 생명을 구할 수 있다고 말한다.[7] 그것은 유전자 드라이브 기술을 통해 가능하지만, 조심스럽게 접근하지 않으면 전체 생태계에 영향을 미칠 수 있다. 예컨대, 유전자 드라이브 생물 한 마리가 야생 환경에 풀려나고 통제되지 않으면, 전 세계의 종 전체가 영향을 받을 수 있는 것이다. 이에 미국 과학·공학·의학 국립 학술원(The National Academies of Science, Engineering, Medicine)은 2016년 유전자 드라이브 기술을 책임 있게 활용하기 위한 지침을 발표한 바 있다.[8] 출처: 엠아이티 테크놀로지 리뷰[9]
|
지역사회에서 벌이는 토론은 열리는 위치는 다를지라도 비슷한 결론으로 이어집니다. 주민 일부는 에스벨트의 견해에 찬성하며, 지금까지 국가도, 자신도 쥐를 효과적으로 제거하지 못했는데 좋은 해결책을 가져온 에스벨트에게 감사를 표합니다. 그러나, 일부는 그런 주장에 반대하거나 반감을 표합니다. 인간이 그렇게 개입할 권한이 있는지를 묻는 사람들이 있습니다. 더 나아가, 그것이 이전의 문제 상황을 반복하는 것은 아닌지 묻는 이도 있습니다. 사람이 환경을 바꾸자고 하여 지금의 문제가 도래했는데, 다시 바꾼다고 손을 대 봐야 다른 문제가 발생하는 것뿐 아니냐는 거지요. 이들이 서구 문물의 자연파괴를 지켜본 마오리족의 후손이기에, 억측일 뿐이라고 무시할 수만은 없습니다.
한편, 유전자 조작 생물을 풀어놓는 것을 반대하는 이들이 있지요. 주로 환경 운동 단체에 속해 환경보호를 주장하는 사람들이지요. 주로 기술의 영향력을 측정할 수 없다는 것이 반대 의견을 표명하는데 강력하게 작용합니다. 유전자 조작 모기를 풀어놓는 것도 걱정되는 일이지만 그냥 불임 모기는 그냥 사멸하면 다시 원래대로 군체가 회복될 수 있습니다. 그러나 유전자 드라이브 기술로 조작한 모기는 한 종(種) 또는 한 속(屬)의 멸절로 끝나기만 할까요. 다른 환경적 영향을 미칠 수도 있지 않을까요. 유전자를 조작하는 유전자가 잘못 작동하여, 예측하지 못했던 생명체의 탄생으로 이어지지는 않을까요. 유전자 조작 반대론자는 여러 SF 작품에서 그린 것처럼, 쉽게 문제를 해결하려다 결국 혹만 더 붙이는 꼴이 되는 것은 아닌지 염려합니다.
이런 의견 중 어느 쪽이 옳다고 하긴 어렵겠죠. 예컨대, 유전자 조작 반대론자의 주장에 관해 연구자들은 위험을 과장한 것일 뿐이라고 주장합니다.[10] 사실 유전자 드라이브 때문에 괴물이 탄생하거나 다른 종에게도 심대한 영향을 미칠 가능성은 거의 없죠. 하지만 이런 염려를 망상으로 치부하고 무시하는 한, 두 견해가 어떤 합의에 도달할 가능성 또한 희박해 보여요. 결국, 우리에게 필요한 것은 이 문제를 놓고 같이 논의할 자리입니다. 가능성과 염려를, 해결과 부작용을 함께 놓고 토론하는 자리. 그 자리에 연구자와 반대자, 그리고 그 기술이 적용될 지역사회의 주민, 즉 당사자가 참여해야 함은 당연한 일일 거예요.
함께 문제를 풀어나가기: 피드백 루프를 통한 정책 수립
유전자 드라이브 기술에 관한 논의가 “어떻게 모여서 논의할 것인가?”의 문제로 수렴한다는 것을 확인했습니다. 이것은 유전자 조작 기술 논의에만 국한하지 않죠. 보건의료의 여러 문제를, 더 나아가 사회의 여러 문제를 해결하기 위해 꼭 필요한 단계이며 그 자체로 하나의 해결책이기도 합니다. 왜냐하면, 이런 문제에 있어 완벽한 최종 해결책이란 없기 때문입니다. 물론, 어떤 일이 벌어진 한참 뒤, 사건과 여파를 회고하면서 이 문제는 이렇게 해결했으면 좋았을 텐데, 하며 하나의 해결책을 사후적으로 구축하는 것은 가능하지요. 우리가 역사를 공부하는 것은 그런 이유 때문이니까요. 하지만 역사적으로 단 한 번도 벌어지지 않은 일에 대해 그렇게 접근하는 것은 불가능합니다. 게다가 과학 발전으로 인한 영향은 이전에 미처 경험해보지 못한 것이 대부분으로 과거 사례에 비추어 현재 사례를 파악하기도 어렵지요. 그렇다면, 우리가 지금 문제에서 제시할 수 있는 해결책은 피드백을 통해 경로를 끊임없이 재수정해 나가는 방안이자, 이를 위한 구체적인 실현 계획 마련입니다. 다시 말하면, 이런 문제에 관해 답을 선뜻 내놓고 이제 문제가 다 해결되었다고 생각하는 대신, 일단 주어진 증거에서 최선의 답을 내놓은 다음 벌어지는 일에 따라 그 답을 계속 고쳐 나가는 과정 자체를 해결책으로 제시해야 한다는 것이죠. 정책 수립 단계부터 수정 가능성을 염두에 두고 피드백 경로와 처리 과정을 미리 고려한 접근, 이를 피드백 루프를 통한 정책 수립이라고 부를 수 있을 거예요.
“유전자 드라이브 기술이 우리와 환경에 어떤 영향을 줄까?”라는 질문에 관해 우리는 지금 답을 다 알지 못합니다. 일부는 예측 가능한 귀결도 있고, 아예 예상할 수 없을 부작용도 있겠죠. 미리 대안을 준비할 수 있는 부수작용도 있겠지만, 생각하지 못한 영역에 영향을 미칠 수도 있을 거예요. 그렇다면, 유전자 드라이브 기술을 적용한 생물을 연구하고 방생하며 그 영향을 추적하는 과정에서 우리는 발생하는 결과를 계속 확인하고, 처음 내린 결론을 다시금 수정하며, 예상치 못한 영향을 반영하여 정책을 변화시킬 수 있도록 의견 수렴과 반영의 구조를 애초부터 마련해야 한다는 결론에 도달하게 됩니다. 예컨대 연구자, 반대자, 지역사회 주민으로 이뤄진 합의체를 구성하여 연구 적용에 관한 결론을 내린 뒤 합의체를 해산하는 것이 아니라 위원회로 계속 운영해야 한다는 것입니다. 위원회는 그저 내린 결론이 잘 이행되고 있는지 감시·감독하는 것이 아니라 이전에 내린 결론이 새로 밝혀진 과학적 증거에서도 유지 가능한지를 논의하고, 예상하지 못했던 문제가 제기되면 이를 수용하는 방안도 함께 가지고 있어야 합니다.
그것은 결국 우리가 현재 지닌 의견이, 과학적 증거가 얼마든지 바뀔 수 있다는 인식에 기초합니다. 흔히들 윤리는 답이 없는 문제라고 하죠. 그러나, 제가 보기엔 아직 우리에게 답이 알려지지 않은 문제라고 하는 편이 더 정확한 것 같아요. 먼 훗날 언젠가는 답을 알 수 있을 겁니다. 하지만 당장 문제에 당면한 우리는 그 답을 당겨서 알아낼 순 없지요. 사태가 전개돼 봐야 문제도, 답도 조금씩 풀어질 것이기 때문입니다. 그렇다면 현명한 선택은, 앞으로 나아가면서 밝혀질 상황과 사태에 반응할 수 있는 조직과 정책을 미리 마련하는 것일 거예요. 우리 생명체가 환경에 모든 답을 가진 대신, 환경에 끊임없이 적응하며 자신을 조정해 나가며 살아가는 것처럼 말이죠.
김준혁/치과의사·의료윤리학자 junhewk.kim@gmail.com
참고문헌
참고문헌
1. Yong E. New Zealand’s War on Rats Could Change the World. The Atlantic [Internet]. Nov 16, 2017 [cited at Dec 5, 2019]. Retrieved from: https://www.theatlantic.com/science/archive/2017/11/new-zealand-predator-free-2050-rats-gene-drive-ruh-roh/546011/.
2. 질병관리본부. 말라리아. 질병관리본부 [Internet]. 2018년 5월 3일 [cited at 2019년 12월 11일]. Retrieved from: http://health.cdc.go.kr/health/mobileweb/content/group_view.jsp?CID=E63D09DB2A.
3. 김양중. 인천 영종도서 ‘뎅기열 바이러스’ 모기 발견. 한겨레 [Internet]. 2019년 7월 15일 [cited at 2019년 12월 11일]. Retrieved from: http://www.hani.co.kr/arti/society/health/901878.html.
4. 김은기. 말라리아모기, 불임유전자 지닌 ‘내시모기’ 퍼트려 없앤다. 중앙SUNDAY [Internet]. 2019년 8월 3일 [cited at 2019년 12월 11일]. Retrieved from: https://news.joins.com/article/23542903.
5. 이성규. 유전자변형 모기, 찬반 논란. 사이언스타임즈 [Internet]. 2012년 7월 25일 [cited at 2019년 12월 11일]. Retrieved from: https://www.sciencetimes.co.kr/?news=%EC%9C%A0%EC%A0%84%EC%9E%90%EB%B3%80%ED%98%95-%EB%AA%A8%EA%B8%B0-%EC%B0%AC%EB%B0%98-%EB%85%BC%EB%9E%80.
6. Kyrou K, Hammond AM, Galizi R, et al. A CRISPR-Cas9 gene drive targeting doublesex causes complete population suppression in caged Anopheles gambiae mosquitoes. Nat Biotechnol. 2018;36:1062-66.
7. Venkatraman V. Turning point: Kevin Esvelt. Nature 2016;536:117.
8. Committee on Gene Drive Research in Non-Human Organisms: Recommendations for Responsible Conduct. Gene Drives on the Horizon: Advancing Science, Navigating Uncertainty, and Aligning Research with Public Values. The National Academies of Sciences, Engineering, Medicine [Internet]. Jun 2016 [cited at Dec 15, 2019]. Retrieved from: http://nas-sites.org/gene-drives/files/2015/08/Gene-Drives-Brief06.pdf.
9. Regalado A. Meet the Moralist Policing Gene Drives, A Technology That Messes with Evolution. MIT Technology Review [Internet]. Jun 7, 2016 [cited at Dec 15, 2019]. Retrieved from: https://www.technologyreview.com/s/601634/meet-the-moralist-policing-gene-drives-a-technology-that-messes-with-evolution/.
10. Jacobsen R. Deleting a Species. Pacific Standard [Internet]. Sep 7, 2018 [cited at Dec 11, 2019]. Retrieved from: https://psmag.com/magazine/deleting-a-species-genetically-engineering-an-extinction
광고







기사공유하기